| Главная » Информация » Решение задачи 9.3 по ПАХТ из задачника Павлова Романкова Носкова |
Решение задачи 9.3 по ПАХТ из задачника Павлова Романкова Носкова
Решение задачи 9.3 по ПАХТ из задачника Павлова Романкова Носкова
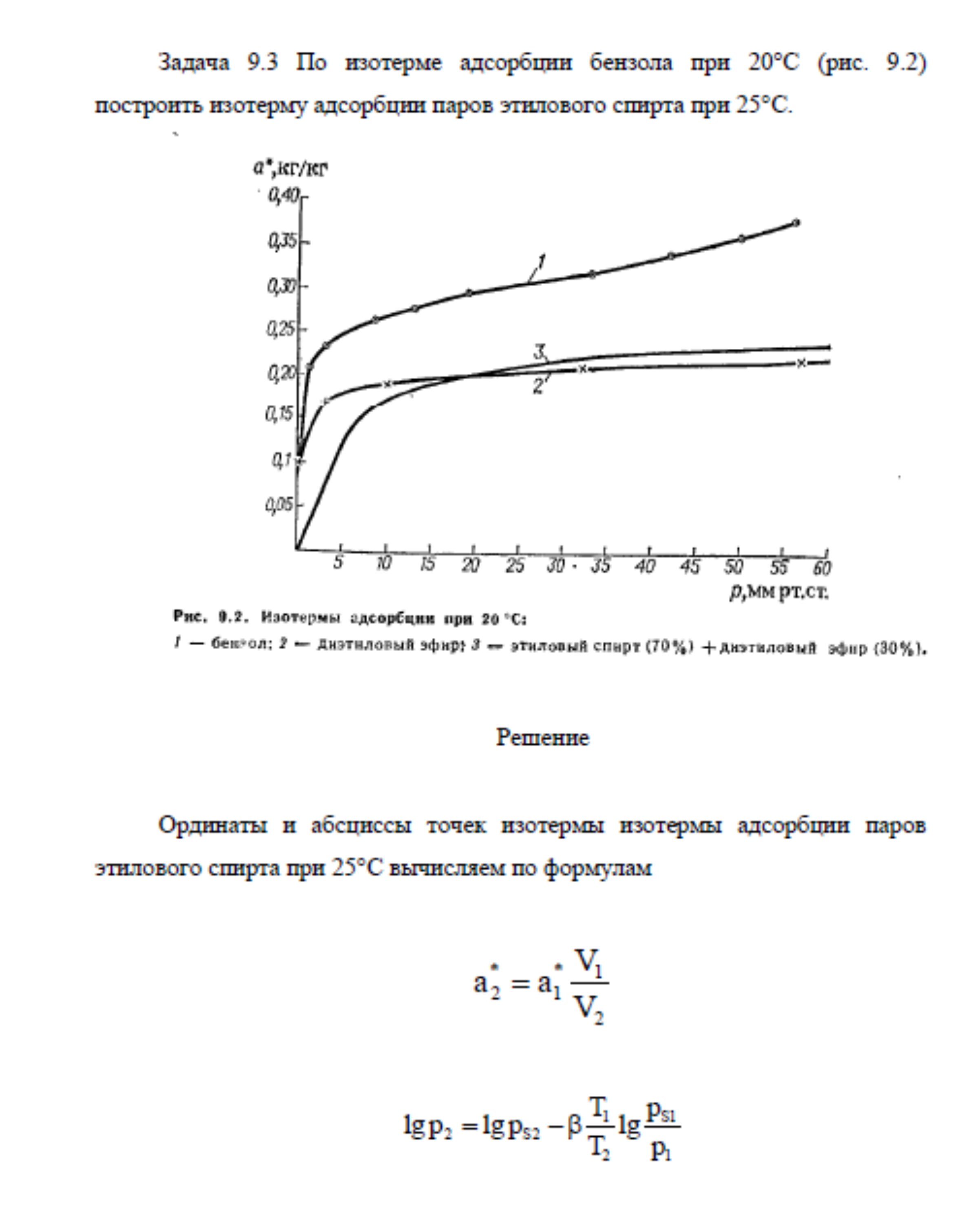
9.3. По изотерме адсорбции бензола при 20 °С (рис. 9.2) построить изотерму адсорбции паров этилового спирта при 25 °С.
Купить эту задачу за 400 рублей онлайн


Прошу обратить внимание, что при покупке решений задач по ПАХТ на сайте
Вам в почту приходит не сам файл решения, а ссылка на файл решения, который нужно скачать по этой ссылке СНАЧАЛА НА ЖЕСТКИЙ ДИСК своего компьютера.
Открывать и просматривать решения задач нужно с жесткого диска своего компьютера.
Файл решения приходит к Вам в трёх вариантах:
1 - ссылка - это формат ПДФ.
2 - ссылка - это архив, который нужно распаковать и уже там будет решение в ворде.
3 - ссылка - это архив, который нужно распаковать и уже там будет решение в ПДФ.
Если у Вас нет опыта оплаты и получения заказа через платежную систему «Робокасса», то Вы можете посмотреть видеролик на этой странице, где эта процедура подробно рассмотрена.
Если у Вас возникли вопросы и что-то не получается
Вы всегда можете задать вопрос через форму обратной связи задать вопрос

Во всех индустриально развитых странах производство азотных удобрений в настоящее время является одной из основных отраслей химической промышленности. Производство азотных удобрений в мире за последние 30 лет выросло в 5 раз. Производству азотных удобрений и их основы аммиака в нашей стране всегда уделялось первостепенное внимание. В России насчитывается около десятка крупных предприятий по производству азотных удобрений, в их число входит и березниковское ОАО «Азот». Основным агрегатом является агрегат производства аммиака, проектная годовая мощность которого составляет 450 тыс. тонн в год. Задача дипломного проекта получение экономического эффекта от реконструкции отделения риформинга, являющегося одной из подготовительной стадий в производстве аммиака. В частности, реконструируется низкотемпературный конвертор монооксида углерода второй ступени отделения риформинга. Решение задачи 9.3 по ПАХТ из задачника Павлова Романкова Носкова
Основными аппаратами отделения риформинга являются конверторы первой ступени, который также называют среднетемпературным, и торой ступени низкотемпературный. В конверторах происходит реакция взаимодействия монооксида углерода и паров воды, в результате получают водород, идущий на синтез, и диоксид углерода, необходимый для производства карбамида. Рассмотрим технологическую схему отделения риформинга.
На вход отделения риформинга подаётся парогазовая смесь, которая поступает в конвертор первой ступени, где при температуре 400 С происходит первая стадия конверсии монооксида углерода, остаточное содержание которого на выходе из конвертора составляет 2…3 %. Затем парогазовая смесь, проходя через котёл-утилизатор и теплообменник азотоводородной смеси, где температура смеси, попадает в поглотитель каталитических ядов, где из неё удаляется хлор резко снижающий активность низкотемпературного катализатора. После поглотителя каталитических ядов смесь поступает в конвертор второй ступени, где при температуре 250 С содержание монооксида углерода снижается до 0,2…0,5 %. Основными приборами, контролирующими протекание процесса являются термопары, установленные в конверторах и поглотителе, а также газоанализаторы, которые контролируют состав парогазовой смеси на всех стадиях конверсии. По изотерме адсорбции бензола при 20 °С (рис. 9.2) построить изотерму адсорбции паров этилового спирта при 25 °С.
Отделение конверсии представлено оборудованием расположенным на открытом пространстве, в основном это колонные аппараты. Высота среднетемпературного конвертора составляет 32 метра, поглотителя каталитических ядов около 9 метров и низкотемпературного конвертора 23 метра.
Конвертор монооксида углерода до реконструкции представляет собой аппарат, состоящий из двух параллельных камер, расположенных одна над другой с насадкой полочного типа. В качестве катализатора используется железохромовый катализатор марки НТК-4, температура зажигания которого около 200 С. Парогазовая смесь поступает в верхнюю часть камер и под давлением 3,7 МПа проходит через слой катализатора. Недостаток данной конструкции состоит в том, что гидравлическое сопротивление катализатора составляет 100 КПа.
В ходе реконструкции предлагается заменить насадку полочного типа на насадку радиального типа, благодаря чему гидравлическое сопротивление слоя катализатора снижается до 5,6 КПа. Радиальная насадка представляет собой центральную трубу, состоящую из пяти секций, и 116 периферийных труб, закреплённых в кольце-окрайке. Парогазовая смесь поступает в периферийные трубы, где направление её движения изменяется на радиальное, проходит через слой катализатора и выводится из аппарата по перфорированной центральной трубе. Так как гидравлическое сопротивление слоя катализатора снижается в ходе реконструкции на 94,4 КПа, т.е. давление на выходе из конвертора повышается на эту величину, то это влечёт за собой повышение на всасе первой ступени компрессора азото-водородной смеси. Следовательно снижается общая степень сжатия компрессором, снижается расход пара давлением 10 МПа, приводящего в действие турбину компрессора. Переход на радиальную насадку в конверторе позволяет увеличить объём низкотемпературного катализатора, что приводит к уменьшению содержания доли монооксида углерода на выходе, благодаря более высокой степени конверсии. Уменьшение конечного содержания монооксида углерода после конверсии приводит к уменьшению расхода природного газа на технологические нужды.
Центральная труба состоит из пяти секций, которые монтируются вместе внутри аппарата. Секции центральной трубы перфорированы по всей площади отверстиями диаметром 6 мм. Материал трубы сталь 12Х18Н10Т, так среда внутри аппарата коррозионная по водороду. Снаружи секции покрыты двумя слоями нержавеющей сетки.
Периферийные трубы расположены по окружности, закрепляются в кольце-окрайке хомутами. Периферийные трубы выполнены из стали 12Х18Н10Т, снаружи также покрыты двумя слоями нержавеющей сетки.
Кольцо-окрайка служит для крепления периферийных труб. Оно располагается на балках настила, выполненных также из нержавеющей стали.
В дипломном проекте выполнены технологические и прочностные расчёты. В частности: расчёт толщины стенки цилиндрической обечайки, расчёт эллиптического днища, эллиптической крышки, расчёт на устойчивость обечайки нижней камеры, промежуточной и опорной обечаек, а также расчёт колонного аппарата на ветровую нагрузку.
В необходимом объёме отражён раздел КИПиА, техника безопасности, технико-экономические расчёты. В разделе КИПиА, согласно задания рассмотрен контур регулирования температуры в среднетемпературном конверторе. В разделе техники безопасности отражена классификация цеха по пожаро-, взрывоопасности, санитарно-гигиенические мероприятия и необходимый состав бытовых помещений. В разделе технико-экономических расчётов проведено маркетинговое исследование, рассчитана себестоимость продукции, срок окупаемости, прибыль, полученная в результате реконструкции, расчёт постоянных и переменных издержек.
Соединения азота играют исключительно важную роль в жизни на Земле. Азот - один из наиболее распространённых элементов в земной коре (около 0,04 %), а содержание его в воздухе составляет 78 %. Во всех индустриально развитых странах азотная промышленность в настоящее время является одной из основных отраслей.
Производству азотных удобрений и их основы - аммиака в нашей стране всегда уделялось первостепенное внимание. Среднегодовой темп прироста производства аммиака за последние 20 лет составлял 10…19 %. Аммиак в настоящее время является основным промежуточным продуктом для получения огромного числа различных азотосодержащих соединений. Производство азотных удобрений в мире, начиная с 1960 года, возросло в 5 раз. Азотная промышленность по темпам развития, объёмам производства продукции, размерам основного капитала, расходам на научные исследования и опытно-конструкторские разработки занимает среди других отраслей мировой промышленности одно из ведущих мест. Решение задачи 9.3 по ПАХТ из задачника Павлова Романкова Носкова
Березниковское ОАО «Азот» является одним из крупнейших производителей аммиака и азотных удобрений в России. Основным агрегатом является агрегат производства аммиака (цеха 1А, 1Б), проектная годовая мощность которого составляет 450 тыс. тонн в год.
В частности, реконструируется низкотемпературный конвертор монооксида углерода второй ступени отделения риформинга.
В результате реконструкции, т.е. после замены полочной насадки на радиальную, гидравлическое сопротивление конвертора снижается до 5,6 кПа. Таким образом, снижение гидравлического сопротивления конвертора ожидается на:
Это влечёт за собой повышение давления на всасе первой ступени компрессора азото-водородной смеси с 2450 кПа до:
Увеличение абсолютного давления в 1,0385 раза, т.е. на 3,85 % приводит к уменьшению общей степени сжатия компрессора во столько же раз. В этом случае потребляемая компрессором мощность уменьшается в 1,014…1,016 раза, т.е. на 1,4…1,6 %. Таким образом, если расход пара давлением 10 МПа для турбины компрессора составлял 338,86 т/ч., то после реконструкции конвертора ожидается уменьшение расхода пара до:
Оказывается возможным снизить выработку пара высоких параметров вспомогательным котлом отделения конверсии метана с 96,06 до 91,24…90,83 т/ч.
Расход природного газа на сжигание в горелках вспомогательного котла в результате повышения давления на всасе компрессора азото-водородной смеси может быть уменьшен на 243…269 м3/ч. или на 4,29…4,75 м3/т аммиака.
Переход на радиальную насадку в конверторе позволяет увеличить объём низкотемпературного катализатора, что приводит к уменьшению содержания доли монооксида углерода на выходе из конвертора.
Уменьшение конечного содержания монооксида углерода после конверсии приводит к уменьшению расхода природного газа на технологические нужды, а следовательно и энергозатрат в головных стадиях производства: компрессии природного газа и воздуха, подаваемого в шахтный конвертор, а также природного газа, подаваемого на сжигание в трубчатую печь и огневой подогреватель сероочистки.
1. ТЕХНОЛОГИЧЕСКИЕ РАСЧЁТЫ
1.1. Термодинамический анализ
Реакция конверсии монооксида углерода представляет собой реакцию, протекающую по формуле (1.1.) и называемую так же реакцией конверсии водяного газа. Эта реакция широко используется в промышленности для получения синтез-газа, городского газа и других областях.
CO + H2O = CO2 + H2
То, что эта реакция протекает в присутствии катализаторов было впервые установлено ещё в 1885 году, когда Гемберг и Генри /12/ путём добавления к водяному газу большого количества водяного пара пропускали эту смесь через накалённый докрасна огнеупорный кирпич каталитически конвертировали монооксид углерода в водород и диоксид углерода. Но в то время ещё не был разработан метод прямого синтеза аммиака, и в качестве возможных областей использования водорода можно было назвать лишь искусственное освещение, аэростаты, сварку металлов, металлургию и другие области, поэтому реакция конверсии монооксида углерода в то время считалась не имеющей промышленного значения. В 1913 году немецкий химик Габер с сотрудниками добился успеха в разработке метода прямого синтеза аммиака, вследствие чего возникла проблема получения дешёвого промышленного водорода. Для решения этой проблемы предлагались методы, основанные на газификации различных видов топлива, но, обычно, в газах, получаемых с помощью газификации, помимо водорода содержится изрядное количество монооксида углерода.
Таким образом, реакцию конверсии монооксида углерода исследовали с целью использования в качестве дополнительной стадии процесса получения водорода, однако, в последние годы эту реакцию стали считать экономически выгодной с целью детоксикации городского газа.
Для проведения этой реакции обычно используют железохромовый катализатор, в присутствии которого при температуре 350°…500°С концентрация монооксида углерода в газе понижается до остаточного содержания 2…3 %. Если же использовать низкотемпературный катализатор, то остаточное содержание монооксида углерода можно снизить до уровня порядка 0,2…0,5 %.
Что касается термодинамических данных, то по всем газообразным компонентам, участвующим в реакции, подробные материалы, собираемые многими исследователями, известны давно. В отношении теплоты реакции вначале Льюис, а затем Истмэн и Партингтон предложили формулы.
Формула Льюиса - Рэнделла:
DН = 9570 + 1,81×Т - 4,45×10-3 ×Т2 + 1,36×10-6×Т3 (1.2.)
Формула Истмэна:
DН = 9420 + 3,16×Т - 8,314×10-3 ×Т2 + 5,17×10-6×Т3 (1.3.)
Формула Партингтона - Шиллинга:
DН = 9512 + 1,619×Т – 3,11×10-3 ×Т2 + 1,22×10-6×Т3 (1.4.)
Кроме того, Ойкен вывел взаимоотношение между DН и Т. Из сравнения констант равновесия, найденных по приведённым теплотам реакции, с измеренными константами равновесия Брайант сделал вывод, что наиболее правильными являются формулы Ойкена и Истмэна. Однако, обычно с учётом степени относительной трудности расчёта и степени известности, широко используется формула Льюиса - Рэнделла.
Цель термодинамического анализа, проводимого в данной работе - определение оптимальных параметров или оптимального режима проведения процесса с точки зрения статики. Он проводится для того, чтобы определить возможность протекания реакции конверсии монооксида углерода. О возможности осуществления процесса судят по величине DZ°Т - изменение изобарно- изотермического потенциала. Если при данных условиях DZ°Т < 0, то реакция вероятна, если DZ°Т = 0 - реакция находится в равновесии, если DZ°Т > 0, то реакция не идёт. Однако существуют дополнительные условия, так как реакция может быть невозможна по двум причинам:
1.) термодинамическая причина,
2.) наличие кинетического торможения (необходимо изменение условий, наличие катализатора).
Если DZ°Т < -10000 - реакция возможна при любых условиях, -10000 < DZ°Т < 10000 - реакция возможна с применением катализатора, DZ°Т > 10000 - реакция не пойдёт ни в коем случае. Располагая табличными данными для энтропии и теплот образования компонентов реакции, можно рассчитать значение самой реакции для данных условий. По изотерме адсорбции бензола при 20 °С (рис. 9.2) построить изотерму адсорбции паров этилового спирта при 25 °С.
Реакция (1.1.) - экзотермическая, идёт без изменения объёма, следовательно, V1 = V2 - const.
DZ°Т = DH°i298 - T × DS°i298 (1.5.)
где DН°i298 - изменение теплоты образования компонента
;
DS°i298 - изменение энтропии компонента (кал/моль);
Т- температура, К.
Следовательно, реакция в принципе возможна при изменении условий - снижение температуры, но наличие кинетического торможения может быть нейтрализовано проведением реакции на катализаторе.
1.2. Кинетический анализ
Решение задачи 9.3 по ПАХТ из задачника Павлова Романкова Носкова
Предложено уже большое количество как теоретических, так и эмпирических формул скорости реакции конверсии монооксида углерода. Однако все эти формулы имеют свои достоинства и недостатки, поэтому не было ещё указано всеобщей формулы скорости пригодной в широком диапазоне, но если обобщить все эти формулы, то, в большинстве случаев, считают, что реакция имеет первый порядок по парциальному давлению монооксида углерода и нулевой порядок по парциальному давлению паров воды, а обратная реакция протекает по второму порядку. Благодаря тому, что реакция имеет по парциальному давлению паров воды нулевой порядок, было проведено множество опытов в условиях избытка паров воды и выведенные при этом формулы можно считать формулами близкими к производственным рабочим условиям.
Среди кинетических исследований можно указать, помимо прочего, исследования Мадьера с сотрудниками, изучавшего влияние давления на скорость реакции. Он обнаружил, что между константами скорости и давлением при обычных условиях (n=1) имеется соотношение:
log kP = log k1 – n × log Р (1.8.)
где k - константа скорости реакции;
Р - давление, МПа.
Кроме того Ивановский выяснил, что при температуре реакции 300°…400°C и давлении 10…40 атмосфер имеет силу формула Тёмкина:
lg kc = (1.9.)
Для низкотемпературной области Тёмкин вывел следующую формулу константы скорости для диапазона температур 200°…300°С:
lg kc = (1.10.)
Расчёт ведём при температуре 713К, 523К, 513К:
При t = 440 °C используем формулу (1.9.):
lg k713 = = 20,635
k713 = 8,231
При t=250°С используем формулу (1.10.):
lg k523 = = 8,202
k523 =96,120
При t = 240 °С:
lg k513 = = 8,269
k513 =103,400
При увеличении температуры константа равновесия этой реакции уменьшается. Реакция конверсии монооксида углерода экзотермическая и, согласно принципу Ле-Шателье, уменьшение температуры в зоне реакции благоприятно сказывается на увеличении выхода водорода. С точки зрения термодинамики реакция лучше идёт при уменьшении температуры, но среднетемпературную конверсию ведут при температуре 380°…450°С, а низкотемпературную - при 200°…260°С потому, что в этих пределах работают катализаторы средне- и низкотемпературной конверсии.
Что касается механизма реакции конверсии монооксида углерода, то здесь, как и в случае формулы скорости, также нет абсолютно установленной теории. Однако, в том случае, когда в качестве катализатора применяется окись железа, имеется довольно сильная гипотеза о том, что железо ускоряет реакцию, вступая в повторяющийся окислительно-восстановительный процесс, как это видно из реакций, указанных Эмметом:
4CO + Fe3O4 = 3Fe + 4CO2 (1.11.)
4H2O + 3Fe = Fe3O4 + 4H2 (1.12.)
Уолберт с сотрудниками предположил, что окись железа не восстанавливается до металлического железа, а повторяется окислительно-восстановительный процесс между закисью и окисью железа согласно следующему механизму реакции:
H2O + MO = H2O × MO
H2O × M = H2 × MO2 (1.13.)
H2 × MO2 = H2 + MO2
CO + X = CO × X
где МО - закись железа,
МО2 - окись железа.
Здесь Н2 и Н2О адсорбируются на центрах, отличающихся от адсорбционных центров для СО и если предположить, что последние почти целиком заняты адсорбированным СО, можно объяснить, почему парциальное давление СО не влияет на скорость реакции. В противоположность Хилберту, Сигов с сотрудниками на основе рентгенографического анализа приходит к выводу, что реакция протекает по следующим формулам:
Fe3O4 + CO = 3FeO + CO2 (1.14.)
3FeO + H2O = Fe3O4 + H2O (1.15.)
Однако Богарс с сотрудниками опровергают это мнение, считая, что с термодинамической точки зрения при температурах ниже 550 °С стабильны только Fe и Fe3O4 , а FeO - метастабильна, поэтому реакция по формуле (1.14.) должна затем стабилизироваться, протекая далее по формуле:
FeO + CO = Fe + CO2 (1.16.)
Все указанные выше исследования относятся к катализаторам на основе монооксида железа; в качестве исследований механизма реакции при использовании других катализаторов можно указать на работы Атрощенко /3,4/, который для катализатора ZnO×Cr2O3 предлагает такой механизм: По изотерме адсорбции бензола при 20 °С (рис. 9.2) построить изотерму адсорбции паров этилового спирта при 25 °С.
[K] + H2O = [K]O + H2
[K]O + CO = [K] + CO2 (1.17.)
где [K] - активный комплекс, образующийся на поверхности катализатора (активный центр).
Атрощенко считает стадией, определяющей скорость, последнюю из этих двух реакций по формуле (1.17.). Согласно этой схеме, реакция протекает при переменном окислении и восстановлении поверхности катализатора (без возникновения новой фазы). При проведении процесса конверсии монооксида углерода в промышленных условиях большое влияние оказывает диффузионное торможение, характер которого изменяется в зависимости от пористой структуры, размера, формы гранулы катализатора, а также условий проведения реакции. В промышленных условиях процесс конверсии проходит во внутри диффузионной области. Влияние диффузионного торможения возрастает при увеличении поверхности контакта, а также давления процесса. Установлено, что значительное увеличение скорости реакции как на железохромовом, так и на цинкхроммедном катализаторах наблюдается при увеличении давления до 9,8×105 …14,7×105 Паскалей. Дальнейшее повышение давления практически не влияет на скорость процесса.
Основным технологическим критерием оптимизации для процесса конверсии является значение концентрации монооксида углерода на выходе из реактора второй ступени конверсии /12/. Минимизация содержания монооксида углерода на выходе из второй ступени конверсии достигается подборам температур газа на входах в первую и вторую ступени конверсии. Значение содержания монооксида углерода зависит, однако, не только от входных температур газа, но также и от таких величин, как расход, состав и давление газа на входе в первую ступень конверсии и давление на входе во вторую ступень конверсии.
При реализации необходимых значений температур на входах обеих ступеней конверсии необходимо учитывать следующие ограничения:
- минимальную температуру входа (вытекает из приближения к точке росы входящего пара);
- минимальную температуру газа на выходе (вытекает из прочностных свойств материалов, из которых изготовлены аппараты и трубопроводы).
1.3. Механизм действия катализатора низкотемпературной
конверсии
1.3.1. Анализ состава катализатора
Состав катализатора приведён в таблице 2.
Все промышленные низкотемпературные катализаторы конверсии монооксида углерода имеют в качестве основного компонента металлическую медь и медь, по-видимому, является единственным активным компонентом /8/. Катализатор, состоящий на 100 % из меди в виде достаточно мелких частиц, должен поэтому быть самым активным материалом для этой цели. Однако, при проведении процесса низкотемпературной конверсии мелкие частицы меди укрупняются из-за процесса спекания и можно подсчитать, что минимальный размер кристаллов меди после шести месяцев службы при таких температурах будет равен примерно 1 микрометр. В результате этого активная поверхность меди будет незначительной, а размеры низкотемпературного конвертора должны быть в несколько раз больше существующих. Так как рост кристаллов является общим явлением для катализаторов, то нет смысла рассматривать первоначальную активность кристаллов.
Для того чтобы получить хороший низкотемпературный катализатор, кристаллы меди должны быть мелкими и стабильными. Добавление второго компонента в его состав, например ZnO, помогает стабилизировать кристаллы меди, в этом случае окись цинка будет играть роль разделительного материала. Размер кристаллов меди зависит от стабильности разделительного материала и рабочей температуры, поэтому стабильность монооксида цинка и является тем качеством, которое определяет состояние низкотемпературного катализатора во время работы. Размер кристаллов, стабилизированных только одной окисью цинка, находится в пределах от 10 до 20 нанометров.
По изотерме адсорбции бензола при 20 °С (рис. 9.2) построить изотерму адсорбции паров этилового спирта при 25 °С.
Некоторые катализаторы содержат медь, цинк и окись хрома. В них медь стабилизируется окисью цинка и окисью хрома. Катализатор, имеющий такой состав, может после шести месяцев работы иметь размер кристаллов меди около 8 нанометров. Активность катализаторов такого типа должна быть приблизительно на 50 % выше.
